
Pengertian
Kata "Termodinamika" berasal dari kata thermos (panas) dan dynamic (gerak atau perubahan) yang artinya adalah salah satu cabang dari ilmu fisika yang mempelajari panas dan temperatur, serta hubungan keduanya pada energi dan gerak. Inti dari pembahasan termodinamika ini adalah bagaimana energi dalam bentuk panas dapat mengalir dari satu benda ke benda lain, proses dari aliran energi tersebut, dan akibat yang dihasikan oleh perpindahan energi tersebut. Termodinamika berhubungan erat dengan fisika energi, panas, kerja, entropi dan kespontanan proses.
Aplikasi dan penerapan termodinamika bisa terjadi pada tubuh manusia, peristiwa meniup kopi panas, perkakas elektronik, Refrigerator, mobil, pembangkit listrik dan industri.
Prinsip Termodinamika
Prinsip termodinamika sebenarnya yaitu hal alami yang terjadi dalam kehidupan sehari-hari. Dengan berkembangnya ilmu pengetahuan dan teknologi, termodinamika direkayasa sedemikian rupa sehingga menjadi suatu bentuk mekanisme yang bisa membantu manusia dalam kegiatannya. Penerapan prinsip-prinsip termodinamika yang meliputi Mekanika, Panas dan Kalkulus Diferensial pada ilmu pengetahuan lain ditunjukkan pada Gambar 1.

Sistem Termodinamika
Sistem termodinamika adalah bagian dari jagat raya yang diperhitungkan. Sebuah batasan yang nyata atau imajinasi memisahkan sistem dengan jagat raya, yang disebut lingkungan. Klasifikasi sistem termodinamika berdasarkan pada sifat batas sistem-lingkungan dan perpindahan materi, kalor dan entropi antara sistem dan lingkungan.
Ada tiga jenis sistem berdasarkan jenis pertukaran yang terjadi antara sistem dan lingkungan:
1. Sistem tertutup
Terjadi pertukaran energi (panas dan kerja) tetapi tidak terjadi pertukaran benda dengan lingkungan. Rumah hijau adalah contoh dari sistem tertutup di mana terjadi pertukaran panas tetapi tidak terjadi pertukaran kerja dengan lingkungan. Apakah suatu sistem terjadi pertukaran panas, kerja atau keduanya biasanya dipertimbangkan sebagai sifat pembatasnya:
- Pembatas Adiabatik: tidak memperbolehkan pertukaran panas
- Pembatas Rigid: tidak memperbolehkan pertukaran kerja.
2. Sistem terisolasi
Tak terjadi pertukaran panas, benda atau kerja dengan lingkungan. Contoh dari sistem terisolasi adalah wadah terisolasi, seperti tabung gas terisolasi.
3. Sistem terbuka
Terjadi pertukaran energi (panas dan kerja) dan benda dengan lingkungannya. Sebuah pembatas memperbolehkan pertukaran benda disebut permeabel. Samudra merupakan contoh dari sistem terbuka.
Dalam kenyataan, sebuah sistem tidak dapat terisolasi sepenuhnya dari lingkungan, karena pasti ada terjadi sedikit pencampuran, meskipun hanya penerimaan sedikit penarikan gravitasi. Dalam analisis sistem terisolasi, energi yang masuk ke sistem sama dengan energi yang keluar dari sistem.
Hukum Dasar Termodinamika
Terdapat empat Hukum Dasar yang berlaku di dalam sistem termodinamika, yaitu:
Hukum Awal (Zeroth Law) Termodinamika
Hukum awal menyatakan bahwa dua sistem dalam keadaan setimbang dengan sistem ketiga, maka ketiganya dalam saling setimbang satu dengan lainnya. Hukum ini dimasukkan setelah hukum pertama.
Hukum Pertama Termodinamika
Hukum yang sama juga terkait dengan kasus kekekalan energi. Hukum ini menyatakan perubahan energi dalam dari suatu sistem termodinamika tertutup, sama dengan total dari jumlah energi kalor yang disuplai ke dalam sistem dan kerja yang dilakukan terhadap sistem. Hukum ini dapat diuraikan menjadi beberapa proses, yaitu proses dengan Isokhorik, Isotermik, Isobarik, dan juga adiabatik.
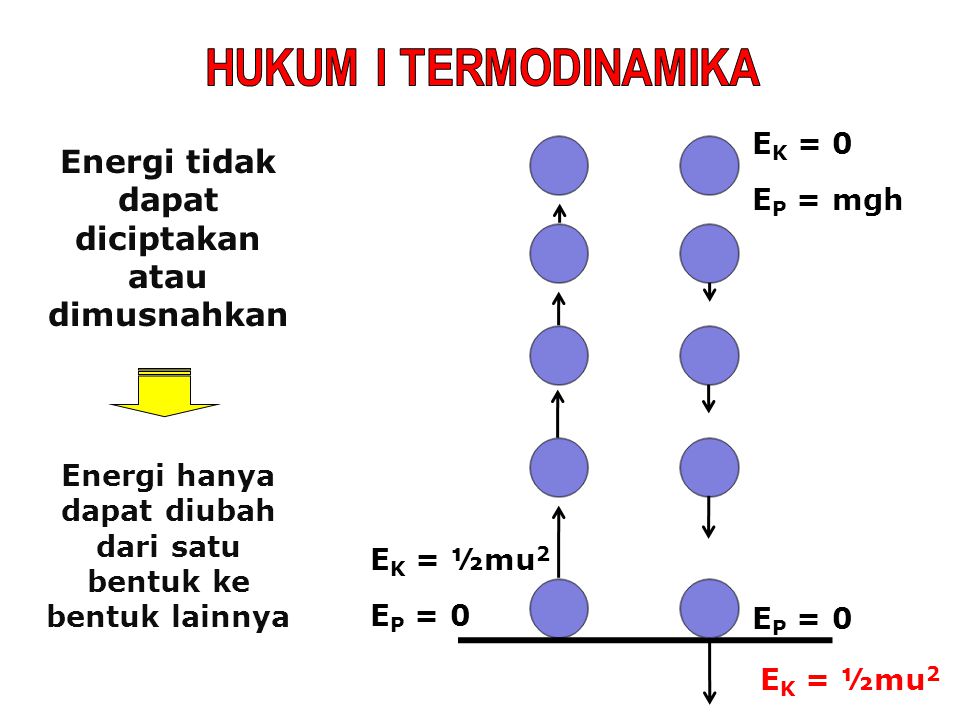

Hukum kedua Termodinamika
Hukum kedua termodinamika terkait dengan entropi. Tidak ada bunyi untuk hukum kedua termodinamika yang ada hanyalah pernyataan kenyataan eksperimental yang dikeluarkan oleh kelvin-plank dan clausius.
Pernyataan clausius: tidak mungkin suatu sistem apapun bekerja sedemikian rupa sehingga hasil satu-satunya adalah perpindahan energi sebagai panas dari sistem dengan temperatur tertentu ke sistem dengan temperatur yang lebih tinggi.
Pernyataan kelvin-planck: tidak mungkin suatu sistem beroperasi dalam siklus termodinamika dan memberikan sejumlah netto kerja kesekeliling sambil menerima energi panas dari satu reservoir termal.(sumber Fundamentals of engineering thermodynamics (Moran J., Shapiro N.M. – 6th ed. – 2007 – Wiley) Bab5).
Total entropi dari suatu sistem termodinamika terisolasi cenderung untuk meningkat seiring dengan meningkatnya waktu, mendekati nilai maksimumnya hal ini disebut dengan prinsip kenaikan entropi” merupakan korolari dari kedua pernyataan diatas (analisis Hukum kedua termodinamika untuk proses dengan menggunakan sifat entropi)(sumber Fundamentals of engineering thermodynamics (Moran J., Shapiro N.M. – 6th ed. – 2007 – Wiley) Bab6).
Hukum ketiga Termodinamika
Hukum ketiga termodinamika terkait dengan temperatur nol absolut. Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut, semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum. Hukum ini juga menyatakan bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.
Tenaga Bebas
Tenaga bebas adalah bagian dari suatu sistem energi yang dapat digunakan untuk reaksi. Tenaga bebas juga merupakan jumlah energi yang tersedia untuk memutus dan selanjutnya membentuk suatu ikatan kimia. Gibbs’ free energy (G), bahwa di dalam sel adalah jumlah energi yang yang terkandung dalam ikatan kimia suatu molekul (dimana T&P adalah constant)
Perubahan dalam energi bebas disebut dengan ΔG, disebut dengan Endergonik jika reaksinya membutuhkan input energi dan Exergonik jika reaksi melepaskan energi bebas.













0 comments:
Post a Comment